和黃醫藥:抗癌藥研究向世界出發
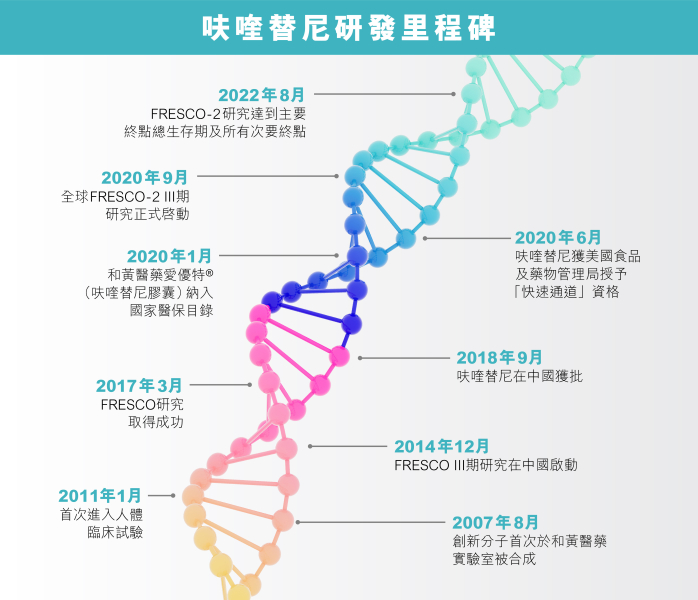
和黃醫藥在帶領呋喹替尼成為重磅藥物的道路上又邁出重要一步。繼呋喹替尼早年於中國大陸獲批上市,讓不少轉移性結直腸癌患者受惠,和黃醫藥又展開一項新的全球性臨床研究,旨在將創新研究成果推廣到世界各地。要達成這一目標殊非易事,尤其是面臨新冠肺炎疫情的重重挑戰。
呋喹替尼:中國獲批
呋喹替尼是和黃醫藥的矚目之作,已在中國完成一項 III 期臨床試驗 — FRESCO 研究,並於 2018 年在中國獲批上市。在世界大部分地區,藥品在通過I期(探索安全劑量)與 II 期(證明臨床療效)研究後,會進入III期臨床試驗,這也是最重要的研究階段之一,通過大規模臨床試驗來確認藥物的療效與安全性。
而這項新的全球 III 期臨床試驗則被命名為 FRESCO-2 研究。展開大型國際研究,不僅需要科學、醫學、營運和行政各方面群策群力,同時亦需要與來自不同地域與文化的持份者通力合作。
在中國,通過原先的 FRESCO 研究,證實該藥品能有效改善患者的總生存期,即該研究的主要終點,並延長無進展生存期,也就是患者與疾病共存而腫瘤並無惡化的時間。研究所涵蓋的轉移性結直腸癌是美國第二大、歐洲第三大的癌症殺手。對於這類致死率如此之高的癌症,患者的預期存活時間往往非常有限,因此無論對患者或是醫生來說,具有統計學和臨床意義的總生存期及無進展生存期改善都是至關重要。與其他現有療法比較,呋喹替尼可額外延緩腫瘤惡化約 1.8 至 2.8 個月;在中國研究中,接受呋喹替尼治療的患者總生存期中位數達到 9.3 個月,較現有的療法取得顯著改善。該創新療法令死亡風險降低 35%,令疾病進展風險降低 74%。對於此類治療選擇十分有限的患者來說,取得這一結果在臨床上具有重要的意義。

走向世界
以中國的臨床研究數據為後盾,和黃醫藥得以充滿信心啓動全球研究,在美國、歐洲、日本與澳洲展開臨床試驗,共涵蓋 14 個國家和地區。全球臨床研究並非只是讓患者試藥,然後觀察療效這般簡單。由於各個國家都有其各自不盡相同的「臨床實踐」,因此抗腫瘤藥物的研究也要相應作出調整。
和黃醫藥需要與所有的合作夥伴共同協作,以確保呋喹替尼的臨床試驗方案符合當地既定的臨床實踐以及符合監管機構的要求。臨床試驗的設計須符合當下的最佳實踐,以便與現有的治療選擇作比較。倘若試驗的設計不合乎治療現狀,可能導致藥物最終無法獲批。
監管機構只是眾多重要持份者的其中一員,而醫生也是相當重要的合作夥伴。在臨床試驗過程中,這些參與研究的醫生通常會被稱為「研究者」或「主診醫生」,以反映他們的角色。他們會在設計試驗階段提供寶貴意見,並會向患者講解潛在的風險與裨益。
在新冠肺炎疫情期間,與監管機構和研究者的合作都面臨著各種挑戰。就算是以往通常被認為作風比較官僚、往往會要求面對面會議的監管機構,在疫情期間也建立了新的線上方案,允許在可能的情況下實行視像診療報告。和黃醫藥研發負責人及首席醫學官石明博士說道:⸢醫生沒有時間可以耽誤。癌症患者正在絕望地等待。⸥


尋找患者;排除偏見
每增加一個參與臨床試驗的「中心」(癌症治療中心) 都涉及大量的研究、成本與時間,所以必須小心挑選合適的「中心」,以便在盡量短的時間內招募到足夠多的患者。若中心太多而成效不彰,則費時失事;而若中心太少,又會不足以滿足招募速度,從而拖慢藥物進入市場和幫助患者的速度。
如石博士所言,要找到患者便要「去有患者的地方」,其中包括了學術機構、社區醫療機構、公立的癌症中心,以及私營的醫療機構,視乎不同國家與當地醫療文化可能情況不一。
和黃醫藥在 15 個月內招募了近 700 名患者,即使在正常情況下已稱得上成績斐然,在新冠肺炎疫情期間更是難能可貴。受到文化、患者基數與當地醫療實踐等因素影響,不同國家或地區招募患者的速度和比例可能各有不同。
歐洲國家通常有很高的醫療需求未被滿足,故患者參與臨床試驗的意願通常較高。在 FRESCO-2 研究中,歐洲患者就佔到超過七成。日本則較具挑戰性,然而研究人員仍然招募到佔總患者人數近一成的患者,令研究也能充分代表日本患者人群,以達到在這個重要市場的註冊要求。
醫生沒有時間可以耽誤。癌症患者正在絕望地等待。
研究設計的過程中往往會調整安慰劑組和治療組的人數比例,以便讓更多的患者能夠獲得藥物治療(例如三分一的患者接受安慰劑,而非一半),從而鼓勵更多患者參與臨床試驗。在雙盲臨床試驗中使用安慰劑,是減少研究結果出現偏頗的方法。即使醫生護士也不知道哪些患者使用安慰劑、那些患者接受了試驗藥物治療。醫生有時以為可以憑觀察副作用來分辨患者,但令人出乎意料的是,許多僅僅服用安慰劑的患者也會出現副作用,更有甚者會開始感覺病情好轉了。臨床試驗過程中必須確保數以百計的「中心」小心執行流程規範,以保證取得符合監管機構要求的有意義的研究結果。研究並會訂定「分層因素」,以顧及患者的不同情況,例如治療開始前患者已被診斷出患有癌症的時間。
在臨床試驗的最後,答案終於揭曉:研究中哪些患者獲發了呋喹替尼、哪些使用安慰劑,以及結果如何。在這重要時刻,藥物的療效如何終於揭開神秘面紗。

成功在望
今年八月, FRESCO-2 研究的結果揭曉:研究達到了總生存期和無進展生存期的預定目標,展示出具有統計學和臨床意義的顯著改善,藥物有效降低死亡風險達 34% 及降低惡化風險達 68%。和黃醫藥團隊正著手向全球多個主要市場的監管機構提交臨床研究數據供註冊審批。呋喹替尼早前已獲美國食品及藥物管理局授予「快速通道」資格。提交上市申請及審批的工作預計於 2022 年底至 2023 年間進行,並預期在 2023 年底與 2024 年初至年中陸續獲批准。
此項令人鼓舞的全球臨床試驗僅僅是一個開始。通過單藥療法或聯合其他療法,呋喹替尼治療的作用機制或有機會亦可在其他類型的癌症上發揮作用。和黃醫藥已循此方向展開更多研究。雖然取得監管審批的過程漫長而複雜,但最終成果或可令患者的生命得以延長,這對患者與其家人來說都是莫大的鼓舞。也正是這一使命,不斷驅使著和黃醫藥與其合作夥伴傾其之力,為世界各地的醫生與患者帶來新的治療方案。
在臨床試驗的最後,答案終於揭曉。